?南開大學藥物化學生物學國家重點實驗室、藥學院陳悅教授課題組在抗腦膠質瘤藥物化學研究方面獲新進展。他們發現了一類化合物,有望成為新的抗多形性膠質母細胞瘤藥物先導化合物——小白菊內酯二聚體。日前,該研究進展發表在美國化學會藥物化學領域國際期刊《藥物化學》上。
多形性膠質母細胞瘤(GBM)是常見的惡性程度最高的腦腫瘤,且難治、易復發,復發后往往沒有標準療法。美國食品藥品管理局最近批準的治療GBM復發的藥物貝伐單抗,也沒有很好地延長中位生存期。因此,目前迫切需要研發更為有效、作用機制獨特的抗GBM治療藥物。
德國著名生物化學家、諾貝爾生理醫學獎獲得者奧托?瓦伯格發現:相較于正常成熟細胞,腫瘤細胞會以更高的效率、吸收更多的葡萄糖來產生能量,伴隨產生大量的乳酸,這種獲取能量的途徑被稱為瓦伯格效應。
研究人員介紹,丙酮酸激酶M2(PKM2)是參與瓦伯格效應的關鍵酶,并在GBM等多種腫瘤中高表達。PKM2的二聚體和四聚體之間存在一種動態平衡,二聚體PKM2主要存在于腫瘤細胞的細胞核中,在腫瘤細胞的增殖、侵襲和轉移中起關鍵作用。激活PKM2可誘導四聚體的形成,降低瓦伯格效應,同時減少二聚體PKM2的入核。因此,激活PKM2被認為是治療腫瘤的新型有效策略。
基于此策略,南開大學陳悅教授課題組研發的抗腦膠質瘤新藥ACT001,已經獲得美國二期臨床試驗批準。此次陳悅教授團隊進一步研究發現,小白菊內酯對PKM2具有一定的激活活性,以此為原料設計合成了一系列小白菊內酯二聚體,并研究它們對PKM2的激活作用、作用機制及其體內外抗GBM活性。
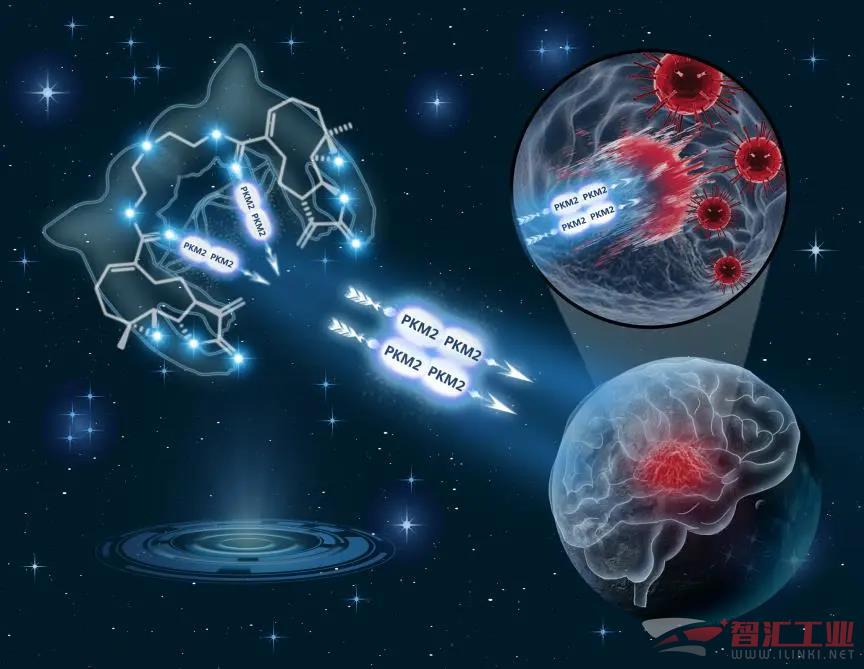
圖為小白菊內酯二聚體通過激活PKM2(丙酮酸激酶M2)抑制多形性膠質母細胞瘤。
研究發現,以二乙二醇為接頭的二聚體是較好的PKM2激活劑,且化合物能顯著抑制一些GBM細胞的增殖和轉移,并誘導其凋亡。基于課題組前期研發的候選藥物ACT001的策略,將化合物轉化為其前藥化合物,化合物能顯著抑制異種移植GBM腫瘤的生長。
“我們發現的最優化合物可能成為新的抗GBM藥物先導化合物,課題組將在此基礎上進一步優化,提高其成藥性,為進一步研發新型抗GBM藥物奠定基礎。”課題組成員張泉副教授說。
(審核編輯: Doris)
分享



