帕金森病是一種難治的神經(jīng)退行性疾病。面對這種頑疾,人們幾乎束手無策。當下獲批的療法,更多也只是“治標不治本”——只能改善癥狀,無法逆轉病情。

▲本研究的負責人高橋淳教授(圖片來源:KANSAI)
這一令人無奈的現(xiàn)狀有望在不遠的將來得到徹底變革。來自日本京都大學(Kyoto University)的高橋淳教授團隊開發(fā)了一種干細胞療法,并在為期2年的實驗里顯著改善了帕金森病癥狀。這項研究也于今日在線發(fā)表在了重磅學術期刊《自然》上。
先來說說帕金森病。人們發(fā)現(xiàn),罹患這種疾病的患者,大腦內(nèi)產(chǎn)生多巴胺的神經(jīng)細胞會出現(xiàn)大量死亡,引起癥狀。事實上,一些研究表明,當患者首次出現(xiàn)癥狀時,他們腦中的多巴胺能神經(jīng)元(DA neuron,下稱DA神經(jīng)元)已經(jīng)有一半以上喪失了功能。因此,許多現(xiàn)有的治療手段是為患者補充多巴胺,試圖恢復腦中正常的多巴胺水平。
近年來,一些研究人員開始考慮其他的創(chuàng)新治療方案。其中,細胞移植吸引了不少科學家的關注。幾項研究發(fā)現(xiàn),將胚胎細胞中的DA神經(jīng)元移植到患者的腦部,可以減輕帕金森病的癥狀。然而,胚胎組織的使用一直充滿著爭議。所以研究人員們也想利用其它的手段,在避免倫理問題產(chǎn)生的同時,對帕金森病患者進行治療。

▲干細胞療法脫胎于一項諾貝爾獎(圖片來源:京都大學)
干細胞技術的興起讓這一切成為可能。2012年,諾貝爾生理學或醫(yī)學獎將榮譽頒發(fā)給了山中伸彌博士和John Bertrand Gurdon博士這兩名在誘導全能干細胞(iPS)領域做出杰出貢獻的科學家,這個里程碑式的事件也標志著干細胞療法時代的全面到來——從皮膚或者血液中分離到的細胞,經(jīng)過簡單的誘導,可以產(chǎn)生全能干細胞,而這些細胞能被進一步分化為具有特定功能的細胞,用于細胞療法。這樣一來,倫理問題就得到了完美的回避。

▲本研究的第一作者菊地哲廣博士(圖片來源:京都大學)
這正是高橋淳教授團隊采取的方法。“我們從不同的iPS細胞系中生成了DA神經(jīng)元,有些來自健康捐贈者,有些則是來自帕金森病患者。”該研究的第一作者菊地哲廣博士說道。在猴子模型中,研究人員們先用細胞毒素殺死了猴子中腦內(nèi)的DA神經(jīng)元,模擬帕金森病的病理,再在這些猴子腦中移植入了誘導出的DA神經(jīng)元。隨后,他們在一項長達兩年的實驗中,評估這款療法的安全性與療效。
實驗的結果令人振奮。盡管這些細胞來自人類,但它們能在猴子的腦中正常發(fā)揮中腦DA神經(jīng)元的作用,運動機能也得到了恢復。在安全性方面,一般對于干細胞療法的擔憂在于,這些細胞是否會誘發(fā)腫瘤的生成。在這項實驗里,這款療法沒有在腦中誘發(fā)任何腫瘤,也沒有引起任何嚴重的免疫反應。這些積極結果也表明了它的潛力。
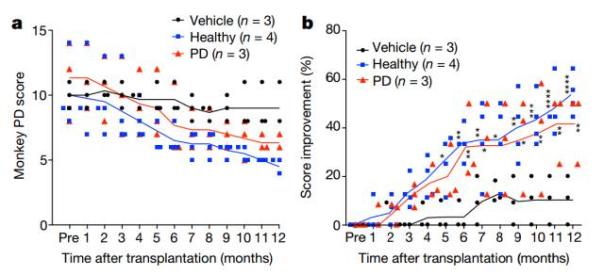
▲干細胞療法降低了猴子的帕金森病評分(圖片來源:《自然》)
“我們的研究發(fā)現(xiàn),從iPS細胞中獲取的DA神經(jīng)元,和從胚胎中腦里獲取的DA神經(jīng)元一樣好。由于前者更容易獲得,我們可以對這些細胞進行標準化的改造,將最好的細胞用于治療。” 高橋淳教授說道。
除了帶來潛在的療法外,這項研究還做出了一個新發(fā)現(xiàn)——先前,大家都假定說細胞療法的效果,僅僅取決于有多少移植的細胞能夠存活。而菊地哲廣博士發(fā)現(xiàn),細胞的質(zhì)量才是關鍵。“每一只動物都從不同的來源獲得了誘導出的細胞。我們發(fā)現(xiàn)細胞質(zhì)量越高,對DA神經(jīng)元的存活影響就越大。”他說道。
為了理解背后的原因,研究人員們又在這些誘導出的細胞中進行了基因表達水平的分析,尋找標志著“高質(zhì)量”的基因。這些分析成功找到了11個足以做出區(qū)分的基因。換句話說,在誘導出的DA神經(jīng)元里,如果這些基因表達量較高,這些細胞的質(zhì)量也就越高,由這些細胞帶來的效果也有望更出色。這對將來的潛在療法有著重要的指導意義。

▲在猴子體內(nèi)取得了令人滿意的成果,這款療法離人類試驗也許已經(jīng)不遠了(圖片來源:京都大學)
研究人員希望這項基于iPS的療法能在明年末招募患者,開啟臨床試驗。如果這項臨床進展順利,我們有望在不遠的將來見證帕金森病細胞療法的問世!
參考資料:
[1] Human iPS cell-derived dopaminergic neurons function in a primate Parkinson’s disease model
[2] Monkeys with Parkinson's disease benefit from human stem cells
(審核編輯: 智匯小新)
分享



